Guide pour le calcul de la densité de courant limite dans un procédé d’électrocoagulation continu à recirculation

1. Introduction
La réduction du chrome hexavalent se produisant dans la cellule électrochimique par les électrodes d’aluminium et de fer, est sujette à des investigations diverses. Avec les électrodes de fer, le traitement du chrome (VI) a été modélisé en considérant la réaction chimique du fer (II) (Pettine et al, 1998 ; Mukhopadhyay et al, 2007), tout en prenant en compte l’oxydation du fer II électrogénéré par l’oxygène de l’air. Avec les électrodes d’aluminium, la diminution exponentielle du Cr au cours du traitement à une densité de courant donnée, observée par Heidmann et Calmona (2007), est due à sa réduction électrochimique directe en suivant la stœchiométrie et dans les conditions de pH neutre à alcalin.
CrO42- + 4H2O + 3e- = Cr(OH)3 + 5OH- (1)
On pense qu’avec le fer, en plus de la réduction électrochimique directe, il y a aussi une action redox chimique du fer II. Cette hypothèse a été rapportée par Barrera-Diaz et al (2003) et considéré par Mukhopadhyay et al (2007) comme non corroborée.
En plus de tout cela, quel pourrait être l’apport du dégagement d’hydrogène à la cathode dans le traitement du chrome (VI) ?
Ce guide s’adresse aux techniciens et ingénieurs utilisant les procédés électrochimiques notamment l’électrocoagulation pour leur permettre de déterminer de façon simple une méthode de calcul de la densité de courant utile pour leur procédé.
2. Méthodologie
Nous avons au niveau de l’électrode un transfert des espèces électroactives par convection et diffusion du liquide vers l’électrode, suivi par leur adsorption et les transferts de charge. Nous avons précisément dans ce cas d’espèce, la réduction électrochimique du CrO42- en Cr(OH)n(3-n)+. Le taux de réduction maximum correspond à la densité de courant limite pour laquelle la concentration des ions chromate à la surface de l’électrode devient nulle.
La loi d’équilibre de masse dans un procédé discontinu se déroulant à la densité de courant limite s’écrit :
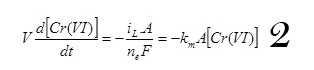
avec km est le coefficient de transfert de masse à l’électrode, A la surface de l’électrode, ne le nombre d’électrons mis en jeu et F la constante de Faraday.
En intégrant l’équation 2, on obtient la relation 3 suivante :
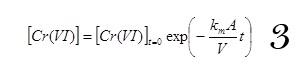
Dans ce cas précis, l’électrocoagulation a été menée à densité de courant constante. La loi de traitement du Cr VI à densité de courant est comparable à une loi se déroulant à la densité de courant limite (Pickett, Coeuret et Stork).
• Pour i< iL, le rendement faradique peut atteindre l’unité et la réduction du chrome VI est régulière et proportionnelle à la densité de courant. On a alors,
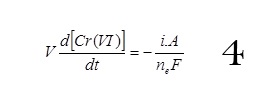
Cette relation provient de la variation linéaire de la concentration de Cr VI avec le temps.
• Pour i < iL, seule la densité limite peut être utilisée dans la relation (3).
Cela montre clairement que la densité de courant limite –ou le coefficient de transfert de matière- est à déterminer.
Estimation du coefficient de transfert de matière à la cathode
La convection de l’effluent se fait avec un coefficient de transfert de matière qui peut être estimé par une loi numérique reliant la masse au transfert momentané de matière. Dans ce cas précis, il y a un dégagement d’hydrogène à la cathode visible par simple observation.
Cette présence de gaz entraîne des formations de bulles des diamètres variant de 20 à 50 µm qui créent une légère turbulence par le phénomène d’accroissement et de détachement des bulles à la surface, ce qui augmente considérablement le transfert de matière. Le coefficient qui en résulte est donc lié au deux phénomènes cités et peut-être fonction des coefficients de ces mêmes phénomènes (Wendt et Kreysa, 1999).
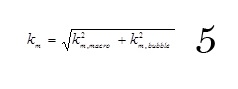
Avec km,macro exprimant l’effet de convection et km,bubble, l’expression de la microturbulence induite par le dégagement d’hydrogène.
En tenant compte du dégagement gazeux faible, l’écoulement peut être supposé laminaire, et donc le coefficient de transfert de matière peut-être estimé par la loi de Lévèque :
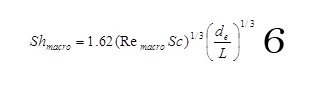
avec
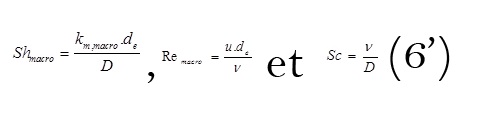
avec de, le diamètre hydraulique, L la longueur de l’électrode, u la vitesse du liquide, υ la viscosité cinématique du liquide et D le coefficient de diffusivité des espèces électroactives.
Le coefficient de transfert de matière résultant du dégagement d’hydrogène peut être estimé comme suit (kreysa et Wendt) :
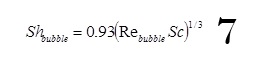
avec
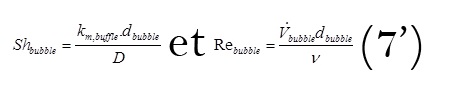
Où est le débit volumique de gaz généré par unité de surface, exprimé en m/s. Le cas du dégagement d’hydrogène nécessite 2 électrons par molécule de gaz. La loi de faraday conduit à l’expression suivante de débit spécifique en fonction de la densité de courant.
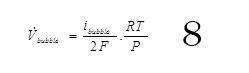
Où R est la constante des gaz parfaits, T la température et P la pression considérée égale à la pression atmosphérique.
La question qu’on se pose à ce niveau, est quelle densité de courant utilisée pour le dégagement de gaz, ibubble. La densité de courant imposée est connue et cette densité représente la somme des densités de courant pour la réduction du Cr VI et le dégagement d’hydrogène.
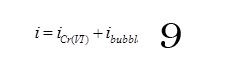
Pour ce calcul, le coefficient de transfert de matière relatif au dégagement gazeux a été surestimé en utilisant la densité de courant appliquée à la relation (8).
La température a été fixée à 25°C, l’effluent a été assimilé à de l’eau pure et les paramètres suivants ont été pris en compte :
u = 0.0025 ms-1, de = 0.0283 m, L = 0.15 m
υ = 0.89 10-6 m2 s-1, D = 1.131 10-9 m2 s-1
La diffusivité des ions chromates a été estimée à partir des tables de mobilité équivalentes en considérant une dilution infinie (Handbook of Chemistry and Physics).
km,macro = 1.47 10-6 m s-1
|
i
(A/m2) |
Débit
vol. h2 |
Re,bubble |
Sh,bubble |
km,bubble |
km,global |
|
50 |
6,35
10-6 |
3,57
10-4 |
4,93
10-1 |
1,11
10-5 |
1,12
10-5 |
|
100 |
1,27
10-5 |
7,13
10-4 |
6,97
10-1 |
1,58
10-5 |
1,58
10-5 |
|
150 |
1,90
10-5 |
1,07
10-3 |
8,53
10-1 |
1,93
10-5 |
1,94
10-5 |
|
200 |
2,54
10-5 |
1,43
10-3 |
9,85
10-1 |
2,23
10-5 |
2,23
10-5 |
3. Résultats : estimation de la densité de courant
La concentration initiale en Cr (VI) de l’effluent est de 200 ppm, ce qui correspond à 3.85 mol/m3, la densité de courant limite est égale à 12.51, 17.69, 21.67 et 25.02 pour les densités de courant appliquées de 50, 100, 150 et 200 A/m2 respectivement.
La réduction électrochimique directe du chrome utilise une fraction de la densité de courant, et l’autre fraction est utilisée pour le dégagement d’hydrogène.
4. Conclusion
Le calcul de l’intensité de courant permet aux praticiens, aux techniciens ou à l’ingénieur effectuant des traitements d’eaux usées par ce procédé de savoir estimer les transferts de charge et de matière s’effectuant pendant l’opération. Cette fiche s’adresse à tout manipulateur de procédé d’électrocoagulation.
5. Pour en savoir plus - Bibliographie indicative
Pickett, D.,J., (1977). Electrochemical reactor design, Elsevier, New York
Coeuret, F., Storck, A., (1984). Eléments de Génie Electrochimique, Lavoisier, Tech & Doc, Paris ;
Zongo, I., Leclerc, J-P., Maiga, H., A., Wéthé, J., Lapicque, F., (2009). Removal of hexavalent chromium from industrial wastewater by electrocoagulation : a comprehensive comparison of aluminium and iron electrodes, Separation and Purification Technology 66 (2009) 159-166p.
Heidmann, I., Calmano, W., (2008). Removal of Zn(II), Cu(II), Ni(II), Ag(I) and Cr(VI) present in aqueous solutions by aluminium electrocoagulation, J. Hazard. Materials 152(3) 934-941 p.
ZONGO Inoussa1, KABORE Aminata2, COMPAORE Jérôme2
1Institut de Recherche en Sciences Appliquées et Technologies (IRSAT), 03 BP 7047 Ouaga 03, Burkina Faso
2Institut de l’Environnement et de Recherches Agricoles (INERA), 04 BP 8645 Ouaga 04, Burkina Faso


Vos commentaires
1. Le 24 décembre 2019 à 23:02, par Oasis En réponse à : Guide pour le calcul de la densité de courant limite dans un procédé d’électrocoagulation continu à recirculation
C’est pour un public spécialisé, ça...! Ce n’est pas trop mon domaine, mais puissent ceux qui y trouveront leur compte être ravi de votre production intellectuelle !